อนุภาคมูลฐาน
อนุภาคมูลฐาน
(Fundamental Particles)
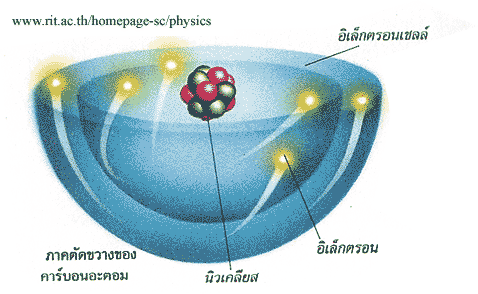
ในแต่ละวัตถุธาตุที่มองเห็น จะประกอบด้วยโครงสร้างที่จับตัวอยู่อย่างสลับซับซ้อนโครงสร้างผลึก (Crystal Structure) จะประกอบด้วย หน่วยเซลล์ (Unit Cells) เป็นจำนวนมากในแต่ละหน่วยเซลล์ จะประกอบด้วยอะตอม (Atom) ที่มีจำนวนมากน้อยต่างกัน ตามลักษณะโครงสร้างแต่ละแบบ และในแต่ละอะตอม จะมีพลังของการยึดเหนี่ยวระหว่าง โปรตอน (Protons) และนิวตรอน (Neutron) จับตัวกันเป็น นิวเคลียส (Nucleus) อยู่ตรงกลางซึ่งมีขนาดเล็กมากอะตอม (Atom) คืออนุภาคที่เล็กที่สุดของธาตุ ซึ่งไม่สามารถแบ่งแยกด้วยวิธีการใด ๆ
ธาตุทุกชนิดประกอบด้วยอะตอมจำนวนมาก ซึ่งอะตอมเหล่านี้ประกอบด้วย อนุภาคที่เล็กที่สุดลงไปอีก เรียกว่าโปรตอน (Proton) นิวตรอน (Neutron) และอิเล็กตรอน (Electron) โปรตอนและนิวตรอนจะปรกอบกันอยู่กึ่งกลางอะตอมเรียกว่า นิวเคลียส (Nucleus) ส่วนอิเล็กตรอนที่เคลื่อนที่อยู่ตามวงโคจรรอบ ๆ นิวเคลียส โดยอิเล็กตรอนที่ประจุไฟฟ้าลบ โปรตอนเป็นประจุไฟฟ้าบวก และนิวตรอนเป็นประจุไฟฟ้ากลาง เมื่ออะตอมเป็นอิสระ จำนวนโปรตอนรอนจะเท่ากับจำนวนอิเล็กตรอน น้ำหนักของอะตอมจะเท่ากับน้ำหนักของโปรตอนกับนิวตรอน ส่วนจำนวนโปรตอนหรืออิเล็กตรอนที่อยู่ในอะตอมที่เรียกว่า Atomic Number เช่น C = 6 หมายถึงคาร์บอน 1 อะตอมหนักเป็น 6 เท่าของโฮโดรเจน 1 อะตอมเป็นค่าของนำหนักอะตอม (Atomic Weight)
ชนิดของอนุภาคมูลฐานของอะตอม
ทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆ นิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
Particle
|
Charge
|
Mass (g)
|
Mass (amu)
|
Proton
|
+1
|
1.6727 x 10-24g
|
1.007316
|
Neutron
|
0
|
1.6750 x 10-24g
|
1.008701
|
Electron
|
-1
|
9.110 x 10-28g
|
0.000549
|
อิเล็กตรอน (Electron) สัญลักษณ์ e – มีแระจุลบ และมีมวลน้อยมากโปรตอน สัญลักษณ์ p + มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน ( เกือบ 2,000 เท่า)’ นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆ กับโปรตอน
เลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์
เลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม (atomic number, Z)2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล (mass number, A) A = Z + N โดยที่ N เป็นจำนวนนิวตรอน( เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A) ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุเขียน (Z) ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุX = สัญลักษณ์ของธาตุ
การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A) ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุเขียน (Z) ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุX = สัญลักษณ์ของธาตุ
คำศัพท์ที่ควรทราบ
ไอโซโทป (Isotope) หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน ไอโซโทน ( Isotone ) หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน
ดังนั้น อะตอมของธาตุลิเทียม ( Li )มีจำนวนโปรตอน = 3 ตัวอิเล็กตรอน = 3 ตัวและนิวตรอน = 4 ตัว
หลักในการจัดเรียงอิเล็กตรอนในอะตอม
1. อิเล็กตรอนที่วิ่งอยู่รอบๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด ( ชั้น K) จะมีพลังงานต่ำที่สุด และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขึ้นๆ ตามลำดับ พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < n =” เลขชั้น” k=”1,L=”2,M=”3,N=”4,O=”5,P=”6″ q=”7″ 2 =” 2″ 2 =” 2×1″ 2 =” 2″ 2 =” 2×16″>
ระดับพลังงาน จำนวนอิเล็กตรอนที่มีได้มากที่สุด
n = 1 (K) 2(1) 2 = 2
n = 2 (L) 2(2) 2 = 8
n = 3 (M) 2(3) 2 = 18
n = 4 (N) 2(4) 2 = 32
n = 5 (O) 2(5) 2 = 32 ( 32 คือ เลขมากสุดที่เป็นไปได้ )
n = 6 (P) 2(6) 2 = 32
n = 7 (Q) 2(7) 2 = 32
จะเห็นว่ากฎออกเตตมีข้อด้อย คือ เมื่อระดับพลังงานมากกว่า n = 4 จะใช้ไม่ได้ อย่างไรก็ตามในธาตุ 20 ธาตุแรก สามารถใช้การจัดเรียงอิเล็กตรอนตามกฎออกเตตได้ดี
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ในแต่ละชั้นย่อย จะมีจำนวน e – ได้ ไม่เกิน ดังนี้
ระดับพลังงานชั้นย่อย s มี e – ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e – ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e – ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e – ได้ไม่เกิน 14 ตัว เขียนเป็น s 2 p 6 d 10 f 14
n = 1 (K) 2(1) 2 = 2
n = 2 (L) 2(2) 2 = 8
n = 3 (M) 2(3) 2 = 18
n = 4 (N) 2(4) 2 = 32
n = 5 (O) 2(5) 2 = 32 ( 32 คือ เลขมากสุดที่เป็นไปได้ )
n = 6 (P) 2(6) 2 = 32
n = 7 (Q) 2(7) 2 = 32
จะเห็นว่ากฎออกเตตมีข้อด้อย คือ เมื่อระดับพลังงานมากกว่า n = 4 จะใช้ไม่ได้ อย่างไรก็ตามในธาตุ 20 ธาตุแรก สามารถใช้การจัดเรียงอิเล็กตรอนตามกฎออกเตตได้ดี
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ในแต่ละชั้นย่อย จะมีจำนวน e – ได้ ไม่เกิน ดังนี้
ระดับพลังงานชั้นย่อย s มี e – ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e – ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e – ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e – ได้ไม่เกิน 14 ตัว เขียนเป็น s 2 p 6 d 10 f 14
จัดเรียงอิเล็กตรอนตามลูกศร ดังรูป
ตัวอย่าง จงจัดเรียงอิเล็กตรอนของธาตุ คัลเซียม ( Ca )ธาตุ Ca มีเลขอะตอม = 20 แสดงว่ามี p = 20 และมี e- = 20 ตัว
การจัดเรียง e- ของธาตุ Ca = 2 , 8 , 8 , 2มีแผนผังการจัดเรียง e- ดังนี้ Ca มีจำนวน e- ในระดับพลังงานชั้นนอกสุด = 2 ตัว จำนวนอิเล็กตรอนในระดับพลังงานชั้นนอกสุด เรียกว่า เวเลนซ์อิเล็กตรอน (Valence electron) ดังนั้น Ca มีเวเลนซ์อิเล็กตรอน = 2 ดังรูป
ตัวอย่าง จงจัดเรียงอิเล็กตรอนของธาตุ คัลเซียม ( Ca )ธาตุ Ca มีเลขอะตอม = 20 แสดงว่ามี p = 20 และมี e- = 20 ตัว
การจัดเรียง e- ของธาตุ Ca = 2 , 8 , 8 , 2มีแผนผังการจัดเรียง e- ดังนี้ Ca มีจำนวน e- ในระดับพลังงานชั้นนอกสุด = 2 ตัว จำนวนอิเล็กตรอนในระดับพลังงานชั้นนอกสุด เรียกว่า เวเลนซ์อิเล็กตรอน (Valence electron) ดังนั้น Ca มีเวเลนซ์อิเล็กตรอน = 2 ดังรูป
แบบจำลองอะตอมของซัมเมอร์ฟิลด์





ความคิดเห็น
แสดงความคิดเห็น